如何让岁月“杀猪刀”刀下留人?让人永葆青春呢

都说“岁月是把杀猪刀”,让年轻貌美的姑娘变成了满脸皱纹的老太太,让活蹦乱跳的小伙子变成了步履蹒跚的老头子。随着岁月流逝,我们的身体发生着怎样的变化呢?我们是从什么时候开始变老的?人类能不能实现长生不老,永葆青春呢?这是千百年来人们不断探索的奥秘。古有秦始皇、汉武帝等古代帝王通过寻仙、服用灵丹妙药追求长生不老;现有诸多著名跨国公司投资抗衰老研究,比如谷歌投资15亿美元成立了研究衰老的Calico公司。当前,随着人类预期寿命的延长,人口老龄化问题越来越严重,衰老相关的退行性疾病,包括阿尔兹海默氏症,癌症,帕金森病,糖尿病等的发病率也增加,抗衰老研究显得愈加迫切。
衰老研究历史和现状
尽管几千年来人们一直在追求长生不老,但是现代意义上的有关衰老的科学研究起始时间并不太长。关键的起始点是二十世纪三十年代末期,科学家发现限制饮食可以延长小鼠和大鼠的寿命,这说明衰老是一个可塑的过程。随着新实验方法的出现,人们对于衰老现象从个体到细胞和分子层面都有了进一步的认识,科学家相继提出了很多理论试图解释衰老。具有代表性的一些理论有:1957年George C。 Williams提出了拮抗基因多效性的衰老进化理论,认为进化会选择对生命早期发育和生长繁殖有利的基因突变,然而这些突变在生命晚期则会加速衰老。1961年Dr。 Hayflick发现细胞老化现象即细胞分裂具有极限并非永生,细胞经过有限次数的分裂之后就进入老化时期。人们进一步发现体细胞每经过一次有丝分裂,位于染色体末端的端粒会随之变短一点,当端粒长度缩短到一定界限的时候,细胞便停止分裂进入老化阶段,这就是衰老的端粒假说。二十世纪五十年代到八十年代科学家还提出了很多解释衰老的理论,主要可以分为两类:以自由基假说,DNA损伤累积以及细胞或组织磨损假说为代表的损伤/错误累积理论,强调环境对分子或者细胞的侵蚀导致损伤的累积,进而引起衰老,“就像机器用久了会坏”是一个不可控的过程;另一类是以免疫理论,内分泌理论为代表的程序性衰老理论,认为衰老就像发育过程一样遵从一个程序性的生物学时间表,这个过程依赖于时序性的开启或者关闭特定基因的表达来控制衰老速度。然而,这些理论通常只能解释部分衰老现象。
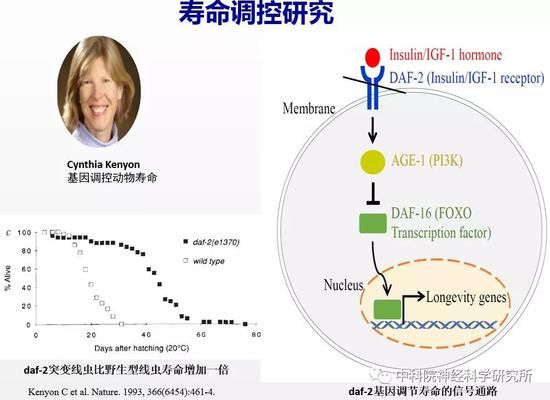
二十世纪九十年代随着分子生物学的发展,衰老研究进入基因时代,基因和衰老现象之间建立起了因果关系。两个里程碑式的工作是:1983年科学家Klass在模式动物线虫中鉴定出第一个长寿突变体,是一个叫age-1的基因突变将线虫寿命延长了40%-60%。这个发现令很多科学家非常惊讶,居然单个基因的突变就能改变寿命的长短。1993年加州大学旧金山分校的Cynthia Kenyon教授发现单个基因daf-2发生突变可以使线虫寿命增加一倍,她提出了寿命受基因控制的理论。接下来的近三十年,科学家发现了上百个长寿基因,这些基因构成了细胞内复杂而有序的信号调控网络。人们对于寿命的调控机制有了一定的认识。
衰老也伴随着行为和认知功能的退化,延长寿命的同时能够终生较好地保持各项生理功能(即健康长寿)是人类的美好愿望。过去人们认为长寿和健康衰老密切关联,但最近的一些研究结果表明二者可由不同机制调控。因此,延长寿命不再是抗衰老的唯一目标。如果长寿而不能健康的老去,在风烛残年中维持体弱多病的生命,这对人们来说其实是种折磨。我们更希望老年时期的生活质量得到改善,实现老而不衰。近年来健康衰老机理受到了越来越多的科学家的关注,但目前这方面的研究还很少。寻找有效途径来延缓衰老过程中的行为能力和认知功能退化已成为抗衰老研究领域的重点和难点。
中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)蔡时青研究员成立实验室以后首先对长寿和行为退化这两者的关系进行了解析,发现一些长寿基因虽然能延长寿命,但并不一定能延缓动物行为功能的退化。探讨衰老相关行为退化机制,寻找实现健康衰老的方法成为了实验室明确的研究方向。第一篇工作同时还阐明了提高神经递质可改善老年动物行为能力,为以后从何入手研究行为退化的调控机制奠定了基础。
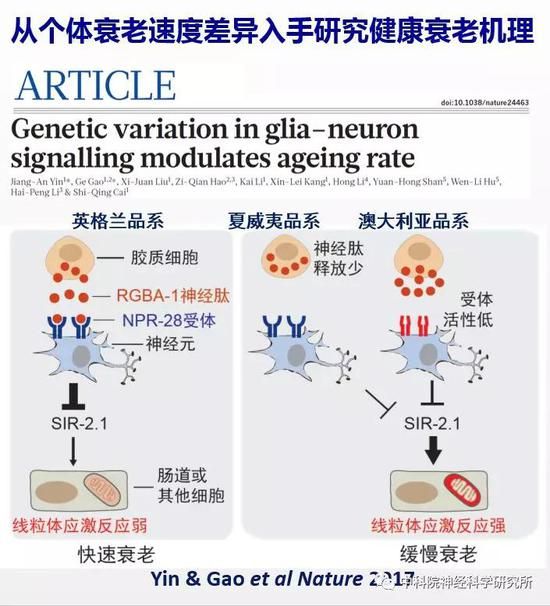
之后他们以神经递质系统在衰老中的变化为衰老的标记,一方面分析个体之间衰老速度差异的遗传基础,发现了一条新的胶质细胞-神经元信号通路调控衰老速度;该研究首次阐述了自然变异影响衰老相关行为功能退化的机制。另一方面综合运用线虫和小鼠这两种模式动物以及人类大脑基因表达数据库,通过全基因组筛选发现新的抗衰老靶标基因,阐明了认知衰老的调控机制,为实现健康衰老提供了新的线索。这项工作于近日在线发表在Nature杂志上。
全基因组遗传筛选发现新的潜在抗衰老基因
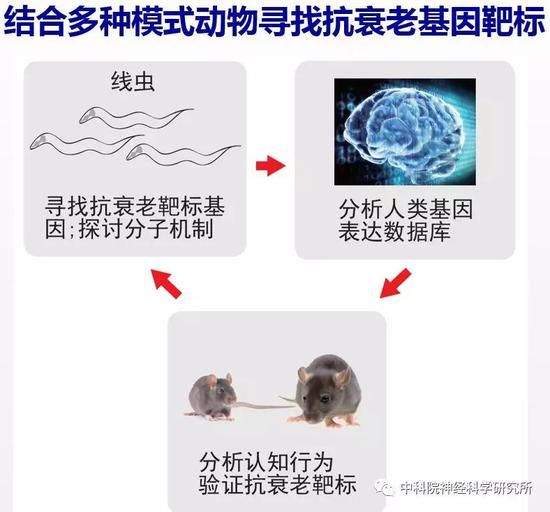
如何寻找调控行为退化的基因?生物学中为了研究一个基因能够发挥什么功能,可以将这个基因从基因组中去除,观察生物体会出现哪些异常,从而可以推测这个基因在生物体中起什么生理功能。当我们想从成千上万的基因中找到特定调控某个生理过程(如发育、衰老等)的基因时,遗传学筛选就是一个非常重要且有效的方法,往往能起到意想不到的效果。在常用于遗传学筛选的模式生物中,研究人员选用了线虫作为研究对象,因为线虫体型微小(身长仅1毫米),易于培养,遗传背景清楚且便于遗传操作,生命周期短,3.5天就可以发育成熟产生后代,整个生命周期大约就是21天。线虫是研究衰老的重要模式生物,许多重要的调控寿命的信号通路都是首先在线虫中发现的,且这些信号通路在哺乳动物中也是保守的。
但即使是在线虫中,检测衰老过程中的行为变化也不是那么简单的,需要通过繁复的实验进行检测。有没有一种衰老的生物学标记,它易于追踪,能反映行为功能退化且适合于大规模筛选呢?研究者们巧妙的化繁为简,想到了神经递质系统。神经递质是介导大脑神经元之间信号传递的化学物质,在衰老过程中神经递质功能异常将导致行为功能退化。改善神经递质功能可提高老年人的行为能力,如多巴胺信号随衰老下降,提高多巴胺神经递质功能可提高老年人认知功能。
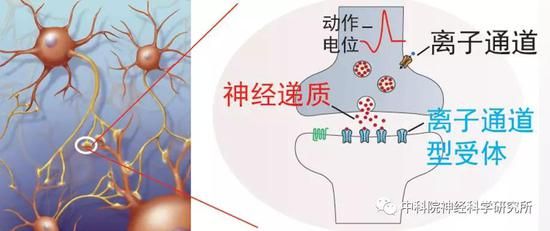
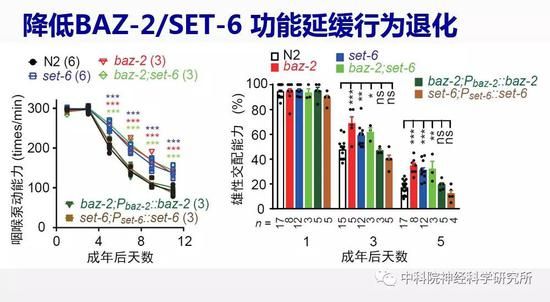
蔡时青实验室早期的工作已经发现,线虫中催化多巴胺合成的一个酶—多巴脱羧酶在衰老过程中表达量下降,导致多巴胺水平降低及相关的一些行为功能的退化。以此为线索,研究人员用荧光蛋白标记多巴脱羧酶,以荧光强度指示衰老过程中多巴胺合成量的变化,通过反向遗传学筛选(一种利用干扰RNA降低目标基因功能的技术)逐个敲低线虫基因组中的16000多个基因来寻找改善多巴胺功能,进而提高老年动物行为能力的基因。经过几轮重复实验确认筛选结果,作者最后找到59个候选基因,其中有10个已经被报道与退行性疾病或者细胞老化有关,而其余49个则是首次发现可影响衰老过程。通过构建这些候选基因的相互作用网络,他们发现有两个基因baz-2和set-6位于网络中的关键节点,且主要表达在神经系统中。研究人员检测线虫行为发现缺失baz-2和set-6的突变线虫的进食能力等各项行为能力随衰老退化的速度相比野生型线虫要慢得多,同时它们还延长了寿命。这些结果说明这两个基因是加速衰老的,降低这两个基因的功能可以延缓衰老。研究人员很欣慰的看到设计的筛选系统是非常有效的,确实找到了抗衰老的潜在靶标基因。

表观遗传相关的抗衰老靶基因调控线粒体功能
那么这两个抗衰老靶基因是怎么调节衰老的呢?研究中通常最困难的不是发现一个生物学现象,而是研究现象背后的生物学机制。刚开始作者探索BAZ-2和SET-6调节衰老的分子机制时也没有头绪。通过序列分析,他们发现这两个基因可能是表观遗传调控因子。于是,他们找到擅长低等真核生物表观遗传学研究的中科院上海巴斯德研究所江陆斌研究员的实验室合作。表观遗传调控不同于大家熟知的遗传调控,是指在不改变基因DNA序列的情况下,基因表达发生了可遗传的变化,并最终导致了表型的变化。江陆斌研究员自2012年建立实验室以来,通过表观遗传学研究手段在疟疾致病机制研究中取得了多个重要突破。不但首创了单细胞真核寄生虫表观遗传基因编辑技术,而且发现了组蛋白甲基化酶PfSETvs与DNA解旋酶PfRecQ1是恶性疟原虫逃避人体免疫反应的关键表观遗传调控因子。通过合作,他们首先证明了线虫SET-6是一个组蛋白甲基化酶,同时也发现BAZ-2和SET-6之间存在相互作用。
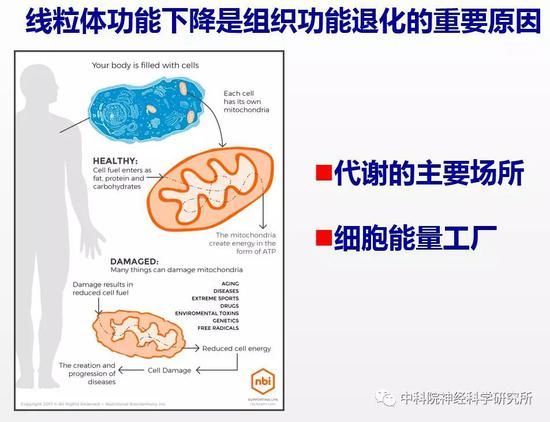
随后,他们采用多种高通量测序方法综合分析,发现BAZ-2和SET-6通过调控线粒体功能相关基因的表观遗传修饰来调节它们的表达。由于线粒体是细胞代谢的主要场所,也是能量工厂,大量研究表明线粒体功能下降是组织功能退化的主要原因。通过检测线虫的线粒体功能,他们发现敲除baz-2和set-6基因确实可以提高线粒体功能,而且敲除这两个基因延缓行为退化是通过提高线粒体功能而实现的。这些结果表明要实现老年个体行为功能的改善,需要激活线粒体的活力。探索抗衰老原因的过程非常艰难,两个实验室通过几年的通力合作,最后详细阐明了这两个全新的抗衰老靶基因的作用原理。
抗衰老靶基因调节小鼠认知衰老
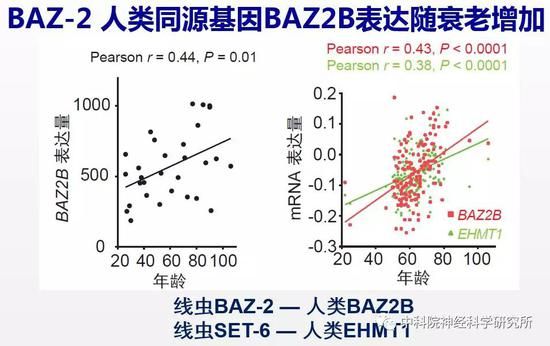
毕竟线虫离人的亲缘关系比较远,这两个抗衰老靶基因在哺乳动物中是否有相同的作用呢?随着高通量测序技术的发展,目前已有很多人类组织样品基因表达的数据库可提供给科学家进行研究。作者充分利用这一资源,分析找到的这两个新的抗衰老靶基因在衰老大脑中有什么样的变化。有意思的是,研究人员发现BAZ-2的人类同源蛋白BAZ2B表达量随衰老增加。
为验证降低BAZ2B功能是否也能抗衰老,研究人员构建了Baz2b基因敲除的小鼠。由于小鼠繁殖周期长,而且小鼠的生命周期长达三年,从开始构建基因敲除小鼠,到去除背景突变,最后把小鼠培养到年老,三年的时间过去了。经过了漫长的准备阶段,作者惊喜的发现降低小鼠Baz2b功能可以减缓小鼠随年龄的体重增加。野生小鼠都会出现“中年发福”的现象,而Baz2b敲除的小鼠则能够在衰老过程中保持更加“苗条”的身材。更重要的是,行为检测的结果表明年老的Baz2b敲除小鼠比野生型小鼠保持了更好的认知能力。说明BAZ2B在哺乳动物中也同样调控衰老进程,是新的抗衰老的靶标基因。
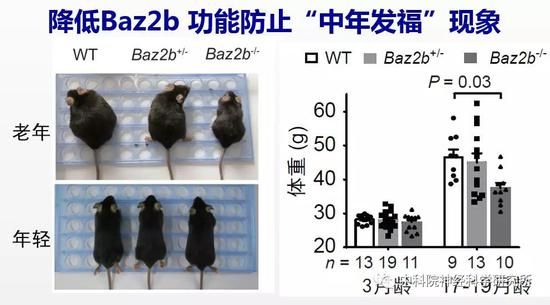
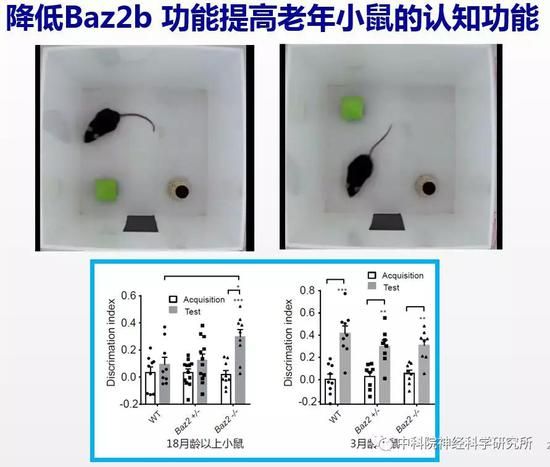
对治疗神经退行性疾病的提示
大量研究表明线粒体功能缺陷在阿尔兹海默氏症疾病的发生和发展中起重要作用。阿尔兹海默氏症,也就是我们通常所说的老年痴呆是引起老年人认知障碍的头号杀手,85岁以上的老年人中有一半可能患老年痴呆,而且目前没有药物能有效治疗这一疾病。由于BAZ2B和SET-6的人类同源蛋白EHMT1保守地调控了线粒体功能,因此,作者还探索了这两个抗衰老靶基因在阿尔兹海默氏症中的变化。他们发现阿尔兹海默氏症病人的大脑中,BAZ2B和EHMT1的表达量与疾病进程呈正相关,和关键线粒体蛋白的表达量则呈负相关。这些结果表明BAZ2B和EHMT1在衰老大脑中表达增加可能是导致阿尔兹海默氏症线粒体功能缺陷的重要原因,并在阿尔兹海默氏症的发生和发展中发挥重要作用。
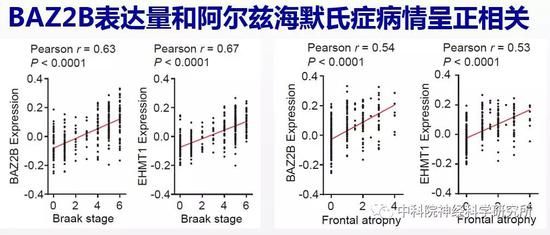
总之,该工作通过全基因组筛选,发现一系列潜在调控行为退化的基因,并鉴定出两个表观遗传调控因子BAZ-2/BAZ2B和SET-6/EHMT1妨碍健康衰老,降低这两个基因的功能可以提高线粒体功能进而改善认知衰老。
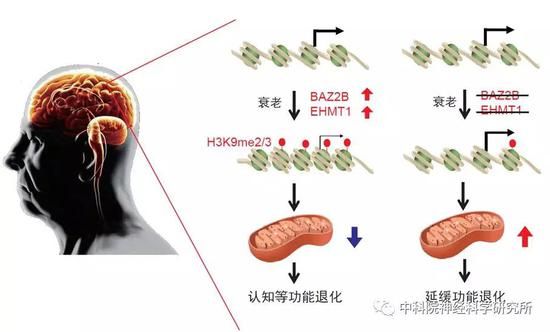
新发现的意义
衰老是神经退行性疾病发生最主要的风险因素,老年性神经退行性疾病的发生和发展在衰老大脑的分子细胞环境中进行,理解大脑衰老的调控机制对防治这些疾病至关重要。
该工作通过全基因组筛选,首次展示了一个广泛的调控衰老相关行为退化的基因图谱,发现一系列潜在调控行为退化的基因,并鉴定出两个表观遗传调控因子BAZ-2/BAZ2B和SET-6/EHMT1妨碍健康衰老,降低这两个基因的功能可以提高线粒体功能进而改善认知衰老。该研究阐明了BAZ2B在认知衰老中的作用,发现了BAZ2B这个全新的抗衰老基因靶标。
该工作还结合多种模式动物,从多层面阐明了认知衰老的调控机制,为今后更加全面的理解健康衰老的机制打下了良好基础;该研究为大脑衰老的机制提供了新的解释,为延缓大脑衰老提供了新的理论依据和作用靶标。
相关推荐
如何让岁月“杀猪刀”刀下留人?让人永葆青春呢
人工智能会让所有人看得起病,还是让大部分人看不起?
5G技术让人兴奋,目前商业化却让人失望
比原子弹更重要的问题:计算机如何让人变得更聪明?
如何让广告效果提升100倍?
会让李佳琦走下坡路的对手,或许不是“人”
高情商的人工智能,可以让人变得更聪明吗?
重返二十岁 :AI换头术如何让好莱坞巨星演回小鲜肉?
手机也能视频抠图,“绿幕侠”如何让人原地“环游世界”?
为什么别人的行业都那么让人羡慕
网址: 如何让岁月“杀猪刀”刀下留人?让人永葆青春呢 http://www.xishuta.com/newsview18428.html
推荐科技快讯

- 1问界商标转让释放信号:赛力斯 95228
- 2人类唯一的出路:变成人工智能 21183
- 3报告:抖音海外版下载量突破1 21148
- 4移动办公如何高效?谷歌研究了 20339
- 5人类唯一的出路: 变成人工智 20338
- 62023年起,银行存取款迎来 10336
- 7五一来了,大数据杀熟又想来, 8596
- 8网传比亚迪一员工泄露华为机密 8505
- 9滴滴出行被投诉价格操纵,网约 8215
- 10顶风作案?金山WPS被指套娃 7230