AlphaFold攻破生物学50年难题,碳基创新加速度
本文来自微信公众号“硅谷101”(ID:svstyle),作者:王晶、泓君,36氪经授权发布。
7月22日,Deepmind在《自然》杂志发表文章称,AlphaFold已经预测出了35万种蛋白质结构,涵盖了98.5%的人类蛋白质组以及20种生物的蛋白质,并开源了它的数据库。
前基因泰克CEO Arthur D. Levinson称这一成就为“划时代的进步”。西湖大学校长施一公评论称,这是人工智能对科学领域最大的一次贡献。
蛋白质由20种氨基酸形成的序列组成,而氨基酸序列的折叠方式决定了蛋白质的作用,这也意味着,预测蛋白质结构对生物研究而言至关重要。但蛋白质可以折叠形成无数形态,以人类目前的计算资源几乎不可能完成结构序列计算。生物学家们会采用冷冻电镜等高精度仪器确定结构,但高级仪器和重复人工实验耗费的成本和时间精力都极大。
1972年,生物化学家克里斯蒂安·安芬森在发表诺贝尔获奖感言时,提出一个著名的假设:理论上,蛋白质的氨基酸序列应该完全决定其三维结构。科学界为了验证这一理论做出了各种探索,CASP蛋白质结构预测比赛即为了检验预测蛋白质结构的技术水平而设立。AlphaFold在2018年的CASP横空出世,但在当时的预测准确性也不到60分,去年11月份则突破性地提高到92.4分。
作为人工智能深入到生物领域的一大突破,AlphaFold很大程度上提高了科研人员的工作效率,加速生物领域创新成果的进展。斯坦福大学生物学博士后史寒朵就提到,如果AlphaFold早两三年出来,她的研究可以加快一年的时间。
AlphaFold未来还需要解决的是未能预测的蛋白质,以及更复杂的小分子对蛋白质结构的影响等问题,这对于药物研究和人类疾病治疗都将起到重要作用。史寒朵猜测,AlphaFold的第二步可能会解决小分子如何改变蛋白质结构,从而影响它的功能,这将会离应用更近一步。
播客《硅谷101》邀请到斯坦福大学生物学博士后史寒朵来全面解析AlphaFold的真实价值在哪里?AlphaFold如果要用于疾病治疗与制药,还需要哪些进展?我们将尽可能通俗地解读AlphaFold的真实意义。
01 如果AlphaFold提前出来,研究项目可以早一年做完
《硅谷101》:近几年生物学界出现了很多如基因编辑技术这类令人振奋的进展,我们这期要谈论的是AlphaFold,属于生物和计算机的交叉领域。AlphaFold预测出35万种蛋白质结构,并且开源了深度学习神经网络的AlphaFold2的信息出来后,很多评论者说“这是人工智能对科学领域最大的一次贡献”,是“一个划时代的进步”。对你来说,AlphaFold的预测和数据库开源对你研究的影响是什么?

图|论文《使用阿尔法折叠进行高度准确的蛋白质结构预测》 (来源:Deepmind)
史寒朵:我是生物和物理的交叉背景,现在的研究方向主要是用物理知识、用定量的方式研究生物学。我现在选择的研究体系是细菌菌群,简单来说,在较复杂的环境里,细菌群体由很多种不同个体组成,可以联想生态学中,有羊和狼,也有其他物种组成的比较复杂的生态链。我现在主要是研究在由细菌组成的生态系统中,不同细菌之间如何互相影响,最终达到平衡的状态。
AlphaFold最近发表的文章虽然强调人类基因组中做出的贡献,但开源的那些蛋白质结构还有约二十种其他生物,这些生物涵盖了植物、细菌、寄生虫等各种各样的细胞。我的研究更多是在细菌这方面,我更关心跟细菌相关的蛋白质。
《硅谷101》:在它开源数据库以后,你有去看它的数据库看你自己现在研究的细菌蛋白质结构是怎样的吗?
史寒朵:当然有。开源后我周围几乎所有同事都在它的网上看,所有人都在搜自己研究的那个蛋白质结构,他们网站没有崩溃,还是让我很惊喜的。
《硅谷101》:为什么能够预测蛋白质结构很厉害?
史寒朵:这就是 AlphaFold 划时代意义的一部分。因为蛋白质结构很重要但又很难破译,只有知道了蛋白质结构,才能更好猜它的功能。
生物研究经常说:结构决定功能。打个比方,我们看见小轿车有四个轮子,就知道应该能开,如果有一天看到有轮子的大卡车,就可以推测它也能在平路上开,而看到一艘船,就推测它不能在陆地上开。
蛋白质来也是类似的,很多功能相似的蛋白质有相似的结构。但因为蛋白质个体很小,显微镜都没法看清结构,除非用像施一公老师在做的冷冻电镜那样很高精度高级的仪器才能看得比较清楚,所以我们很难清楚所研究的蛋白质功能。
AlphaFold能预测结果,这很大程度上提供了高置信度的猜测,告诉我们蛋白质大概长什么样,就可以把预测的结构和已知的其他蛋白质结构进行比较,以猜测它的功能。之后顺着猜测的方向设计实验和验证,这对我们的研究很有帮助,可以省很多时间和精力。
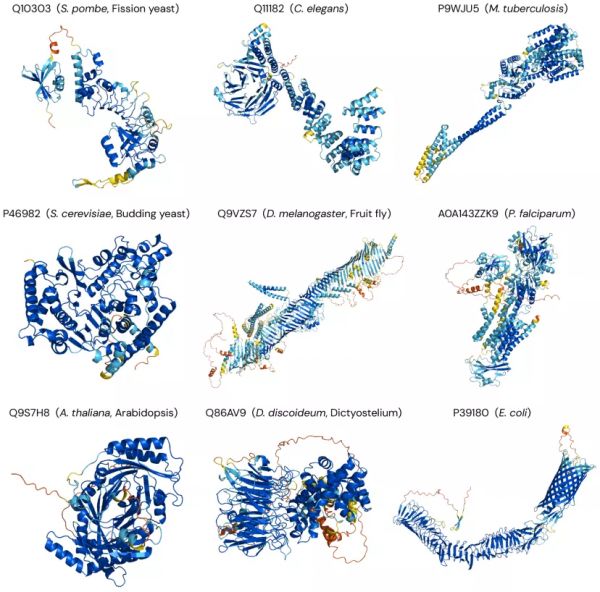
图丨AlphaFold对不同生物体的预测(来源:DeepMind)
《硅谷101》:你们也不知道预测的结果是否准确,但这种算法可以辅助确定蛋白质结构;你们还要再用实验确定一遍结果是否准确,但AlphaFold可以省去很多力气。
史寒朵:对,在生物学或者实验科学里,实验是检验真理的唯一标准,我们只有拿到实验结构,才能非常自信地说,结果表明这个结构是正确的。
好在AlphaFold现在有很多蛋白质是已知结构,或是我们已经对结构有一定猜测,根据这些已知的结果来看AlphaFold预测结果,通常来说都很相近,所以我们也相信,对未知的蛋白质结构,AlphaFold在很大程度上能比较精准地预测。
《硅谷101》:你查完以后,觉得它会改变你现在的整个研究进程和研究方向吗?
史寒朵:这很依赖于我自己课题的进展状况,特别让我激动的是一件事:
两年前我们和普林斯顿的一个教授合作研究一个膜蛋白功能,由于当时不知道膜蛋白的结构,也没有任何信息,所以大概有一年的时间是在猜测这个蛋白质的功能。对它在细菌里起到的作用,设计不同的假设和实验,发现猜想不对就需要回到第一步,这是不断迭代和思考的过程。最后很幸运的是,经过一些反复的过程,最终猜对了蛋白质的功能,和实验结果也是相符的,文章在去年已经发表。
我上周一查AlphaFold对我们这个蛋白质的预测结果,哇,对。所以如果当时就有这样的预测结果,我们就知道它有一些很典型的结构是在其他的膜蛋白中看到过,所以它肯定和蛋白质里的磷脂分子有相互作用。如果AlphaFold能提前两三年出来,我之前那个项目能提早一年做完。
《硅谷101》:它能帮你们加进度。
史寒朵:对,科学中,做研究是好玩但又很折磨人的过程,要不断提出假设,而很多时候可能会不对。
《硅谷101》:你上次说在蛋白质研究中,解结构是最难的,而且基本上解出一个蛋白质的结构,就可以发一篇《Nature》的论文。
史寒朵:对,如果是大家比较关心的、比较重要的结构,解出了结构往往还意味着,我们对它的功能也会有进一步更细致的认知。
《硅谷101》:如果说AlphaFold已经可以预测98.5%的人类蛋白结构的话,是不是说明关于人类每一个蛋白的作用的这些信息都会越来越透明、公开了,就意味着人体的秘密可能会被攻破了?
史寒朵:当然,我们研究生物的都希望有这么一天,我们知道所有蛋白质都在干什么,知道它们会在什么情况下发生什么样的变化。我觉得AlphaFold目前的方向是很有希望的,但可能和大众理想最终从模型就知道所有蛋白质在干什么,还有一定的差距。
《硅谷101》:差距在哪里?
史寒朵:目前预测的结果是98.5%,也就是还有1.5%的蛋白质现在还没有办法很好预测,从技术上讲,是因为其中很大一部分有很多无序结构。想象一下很多蛋白质从产出开始有一个大致固定的结构,AlphaFold就是在预测这个结构本身,还有少部分蛋白质很多变,在很多情况下甚至没有固定的结构。
拿车来比喻,车门可以开关,但你还是能看到它是辆车,但是有一些所谓的无序蛋白就像橡皮泥,是可以很随意捏成想要的形状,它在不同环境中有不同形状,它的结构很不确定,AlphaFold目前的算法对解这类蛋白质比较有困难。
《硅谷101》:蛋白质折叠指的是什么?
史寒朵:蛋白质是一个由20 种氨基酸组成的分子,蛋白质最初被合成出来时实际上是根二维链条。我们可以想象成一根项链上面有 20 种不同的串珠, 即20 种不同氨基酸,不同氨基酸之间会有不同的相互作用,有些相互作用强,有些则弱,甚至有些会排斥。根据这些很神奇的基本物理作用力,最终这根项链会折叠成特定的形状。
最后折叠成的形状就是所谓的蛋白质结构,但我们很难预测,怎么样从肽链开始到最终形成的结构。AlphaFold现在只要知道项链上有多少珠子,每个位置是什么珠子,就能知道它最终折叠成的3D形状。
《硅谷101》:为什么不能直接从第一性原理出发去直接计算,而是需要用AlphaFold这种人工智能呢?
史寒朵:不是没有人尝试过用第一性原理计算,基本上对于很短的肽链比如十几个氨基酸,我们可以做。如果太多的话,复杂度是指数型上涨,最终很大程度受到了计算能力的限制。
《硅谷101》:它可能有无限种可能的情况,因为它可以折叠成无数种形态,那个队列无限长,就很难以人的方式计算,要用机器计算。
史寒朵:因为机器计算也要时间,解一个正常大小的蛋白质一般就是上千个氨基酸,现在人类有的计算资源基本上不可能允许我们从第一性原理开始算。
《硅谷101》:蛋白质折叠问题是过去50年里生物学的一个巨大挑战,计算一个蛋白质结构是要10的300次方这样的计算量,要算出来是非常难的。
史寒朵:对。如果用类似穷举的方法,把所有可能的相互作用全算一遍,这个数据听起来是很合理的。
《硅谷101》:宇宙中有多少原子,10的80次方,要靠计算出蛋白质结构的方式几乎不可能的。大家会根据它的一些功能来观察,先排除一些可能性,还有一些像冷冻电镜、核磁共振的方法来算结构。
生物学界每年也会做一些算蛋白质结构的比赛,在过去几年能够算出这些蛋白质结构的都是深度学习算法。其实除了AlphaFold,我注意到华盛顿还有一家公司。
史寒朵:对,Baker Lab的Rose TTA,他们和AlphaFold基本上是同一时间,就是过去这两三周,他们在 《Science》上发表了一篇关于RoseTTA的一个改进算法的文章,这个算法做得也很不错,但只能说AlphaFold的数据库太大,然后精度又略微高一点,所以吸引了更多眼球。
《硅谷101》:你说它的数据库大,但这些数据库是哪里来的?
史寒朵:数据库大指公开的蛋白质结构量比较大。Baker Lab发的一篇文章更多是在讲算法本身,他用算法预测了一些蛋白质的结构,并没有像AlphaFold把20种不同生物,基本所有蛋白全算了一遍。
02 猜测AlphaFold的下一步:小分子结构?
《硅谷101》:我记得AlphaFold第一年参加预测蛋白质结构的比赛CASP的得分就只有六十多分,但第二次很快就拿到92.4的高分,是在去年的十一月份底,到现在仅仅过去半年突然有了这么大的数据库,并且准确率达到了98.5%,为什么可以提高这么快呢?
史寒朵:从18年到去年,他们在算法上应该做了很多有意义的调整改进,从百分之六十几提高到百分之九十几。这个数据的变化应该是算法改进和技术上的加成比较多,可能也有计算机资源,就是摩尔定律的加持,毕竟两年多时间里,计算资源本身也提高很快。
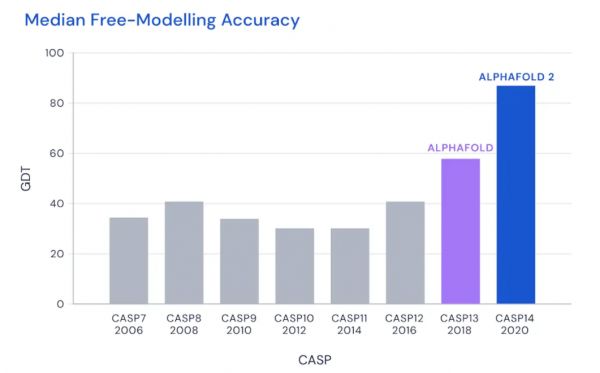
图 | CASP预测蛋白质比赛得分
但说实话,比较去年11月份到现在的算法,我从他们的文章中并没有看出有对算法的本质调整。
我猜测是表面上看起来是进步的,但只是说比赛时,他们只解了一个蛋白质,所以准确度只是根据这一个蛋白质算出,现在有更大数据库,有更多蛋白,他们算的是这么多蛋白的平均的分数。
另外,从去年11月份AlphaFold在比赛中获奖,到一直拖到今年5月份才把文章发出,中间隔了半年时间,有相当一段时间,就是重复跑这个算法,然后把所有不同蛋白质结构全都算了一遍。
《硅谷101》:那他们现在预测到了这么多人类蛋白结构,是一个很大突破,可以用来干什么呢?
史寒朵:从做生物科研的角度来讲,可以让我们很好查找蛋白质结构本身,然后从蛋白质结构本身来猜测蛋白质功能,能够加速科研的进展。
《硅谷101》:那在药物研发跟疾病治疗方面呢?
史寒朵:在这方面它还有一定差距,药物通常指的是小分子而不是蛋白质本身,但小分子其实可以结合在蛋白质上,结合过程中会细微改变蛋白质的结构,从而调节它的功能。
现在AlphaFold出的整个数据库只包括蛋白质本身的,这是非常重要的第一步。我很希望看到的第二步是,把这个过程再做得更复杂一些,能够包括很多小分子,有一些蛋白质对人类的疾病有影响,那我们就想研究什么样的小分子能改变这些蛋白质结构,从而影响它的功能。事实上现在很多制药公司包括初创企业也在做类似的工作。
现在比较多的还是像GeneTech 这种制药大厂,有很大的小分子库,他们有财力合成很多小分子,一种种在实验室里试。想象一下,如果能用类似AlphaFold的方式让计算机来解决,那么效率肯定比一个个在实验中做要快很多。
《硅谷101》:这个蛋白质结构预测公开了之后,每个制药厂针对不同疾病会在细分方向上研究小分子和蛋白质结构结合产生的变化。制药厂可以利用这些人类的蛋白质结构,也可以加快他们药物研发的速度,是不是以后制药厂也会需要养一支 AI 团队呢?
史寒朵:很多大厂现在是有所谓的计算生物学方向,也有做这样一些工作。但谷歌本身能力特别强,计算资源非常丰富,如果有谷歌这样的公司愿意用计算资源和专业人士来做这件事,并把数据公开出来,可能是更高效的过程。
《硅谷101》:这是提速整个行业研究的过程。你刚提到的RTT Rose,他们也做得很不错,只是他们的数据库小一点。每年的CASP比赛中也有很多 AI 算法团队,那决定大家做得好与不好的关键点在哪里?
史寒朵:一个重要因素是计算资源,这也是为什么我觉得谷歌很适合做这件事情。
AlphaFold和华盛顿那一家比起来,很明显的区别是AlphaFold需要的资源要大很多,有明显更大的内存,预测一个蛋白在GPU上所需要的时间也更长。当算力只能支持计算一定的内容时,就不得不做出一些妥协,我估计这也是导致最后性能的差异。
《硅谷101》:相当于是拼算力、拼设备,算法只是其中的一部分,虽然AlphaFold也有很多顶级生物物理学家。
史寒朵:到一定程度时,AI算法和底层设备也是分不开的,有更强的硬件可以算得更快,在算法上就可以做更多调整,让它跑更多次迭代,这个过程中往往能更好提高它的算法表现力。
《硅谷101》:在你们现在的工作中,会有哪些方法预测和检验蛋白质结构?你们的工作是每天对着显微镜看蛋白质分子结构,还是上升到了用计算机跑数据?
史寒朵:大部分科研是“无所不用其极”,我们手里有什么技术,都会尽可能用上。
我们还做不到看蛋白质结构,但如果有机会和结构生物学实验室合作,让他们来帮解结构,我们也非常欢迎的。通常我们会绕开结构,因为结构是一个很难做的过程。
但我们可以猜它有什么样的功能,然后在实验中设计它有这样的功能,考虑用一些方法来增强或抑制它的功能,检验我们的猜想。如果最后验证了是可行的,甚至可以提出更多猜想,当很多猜想在实验中被验证之后,就可以排除掉其他不可能的功能,最后剩下就是唯一可能实现的方式了。
《硅谷101》:现在AlphaFold对于蛋白质结构研究这个方向,是帮助大还是说消灭了这个职业?
史寒朵:说起来很有意思,我也认识几个结构生物学家,他们的日常工作就是解蛋白质结构。很好玩的是,很多人都说,它偏偏就是没有解出我研究的那个蛋白。
《硅谷101》:是因为他们研究的会更难吗?
史寒朵:对。比如像刚刚提到的一些无序蛋白,还有像基因编辑非常火的CRISPR的核心蛋白Cas9,这一次公布的数据库里没有这个蛋白。

《硅谷101》:为什么会解不出Cas9呢?
史寒朵:不是解不出,只是他们没有去解。因为Cas9这个蛋白并不在他们解过的二十种生物里,是从另一种平常大家研究不多的细菌里提取出来的,所以没有也很正常。
但另一方面,结构生物学家们关心的话题是纯生物意义上最关心的一些蛋白,而AlphaFold采取的做法是先找最有意思的生物体,把他们所有的蛋白都做一遍。
我相信如果AlphaFold还继续这个项目,可以继续扩展他们的数据库的话,从原则上讲预测Cas9应该没有任何难度,只是现在还没做。但还有很多大家在生物领域感兴趣的其他蛋白质,AlphaFold目前的数据库还没有扩充到这个阶段。
《硅谷101》:他们已经确定了 98.5% 的人类蛋白质结构,偏偏没有大家感兴趣的是那1.5%。
史寒朵:因为大家感兴趣的很多不是人类蛋白,比如Cas9是从细菌里出来的一个蛋白,只是它对基因编辑很有用,现在大家拿它作为工具使用。
你可能会关心种植物时怎样调整各种植物产出,其中往往也有一些核心蛋白质在控制:比如我要让它开花开得更大,还是结果儿结得更多?果子里葡萄糖更多还是淀粉更多?这些都有特定的酶,也就是蛋白质在调节。
范围实在太广了,平时我们吃的蔬菜水果随便数数也有好几十种,如果真的要完全预测所有蛋白质结构,从计算量来说也得分轻重缓急,一步一步来。
《硅谷101》:你们学校有研究蛋白质结构的实验室吗?
史寒朵:有做计算的,也有做冷冻电镜的。
《硅谷101》:现在还是用冷冻电镜解比较多?
史寒朵:对,冷冻电镜相对来说对样品制备要求更低,同时可以看到更多蛋白质更接近生理状态的结构。

《硅谷101》:那有了AlphaFold还需要冷冻电镜吗?
史寒朵:当然需要了。一是验证。另一个是我们刚刚说的AlphaFold目前只能解出蛋白质本身的结构,但很多小分子会非常细微地改变蛋白质结构,这对它的功能也是很有意义的。目前AlphaFold其实没有这部分信息,但在冷冻电镜上,蛋白质本身的结构和它加一个小分子的结构,做的难度差不多,所以完全有能力做更精细的结构区分。
《硅谷101》:AlphaFold是不是很快就可以加上这一步了?
史寒朵:希望是。如果真的要谈应用的话,有小分子的这个结构可能离应用会更进一步。
《硅谷101》:冷冻电镜的成本大概是多少?比如说用一个冷冻电镜去验证一个结构,这个实验过程大概需要多久呢?
史寒朵:冷冻电镜是比较贵的仪器,斯坦福整个学校也就只买了几台,而且大部分情况下预约也非常紧张。前几年刚买的时候,都宣传说斯坦福的冷冻电镜是北美最大的冷冻电镜中心。有很多实验室都想用冷冻电镜看他们的样品,但因为机器只有这么几台,然后大家经常也要排队。
03 跨学科研究:还要解决沟通问题
《硅谷101》:我知道寒朵你是高中时就拿了国际物理竞赛的第一名面试,那一年其实你也是创下了国际物理竞赛的三个历史,总分第一、实验分第一,也是历史上唯一一个同时获得三个单项第一名的女生。你的很多同学也提到你在北大物理系是大神级的人物,为什么会从物理来转向研究生物?
史寒朵:首先是我个人比较喜欢实验和理论相结合的研究方式。目前物理发展的时间比较长,整个领域有比较明确的区分,我们有实验学家专门做实验,理论学家大部分时间就是在搞理论,这个模式很好,但我个人更喜欢自己能同时做实验和理论。
《硅谷101》:所以算是在跨学科,跨理论和实验。
史寒朵:可以这么说,生物学就给我提供了很好的机会,这些年来也有很多物理计算机背景的人直接来学生物本身,用我们在物理计算机学到的一些知识来解决生物问题,AlphaFold也是一个很典型的例子。
《硅谷101》:除了生物知识之外,AlphaFold也有用到一些物理知识,他们会把研究这个领域的专家叫生物物理学家。
史寒朵:是的,历史上生物学最开始更接近于博物学,大家比较熟悉是达尔文,他们最初开始基本上就是去采集标本,然后记录标本的样子,从这个过程中总结经验。
物理学可以说是反向的过程,先提出一些理论或者简化的数学模型,然后在实验体系中验证,最后总结规律,这个过程中更多是抽象的建模。使用定量分析这些手段其实是物理学最初发展起来,然后逐步渗透到生物学中。所以大家也习惯上把用比较偏物理的手段来解决生物问题的方式,命名为生物物理学。现在的趋势就是,大家都想做所谓的跨学科科研。
《硅谷101》:对,如果你们有一个计算机团队来辅助你们,科研效果会不会产量提高很多。
史寒朵:当然会,想我和我周围的同事也都会写一点代码,事实上我科研中可能有1/3到1/2时间是在电脑面前写代码、算东西,处理数据。我自己实验和在电脑前的工作的时间差不多是一半一半的。
这样也挺好,但是如果有计算机方面的专业人士比我更懂计算机,能更高效地写代码,把代码的复用性做得更好的话,对科研本身会很有好处。
《硅谷101》:你现在有和计算机系合作吗?
史寒朵:我没有,因为我的背景还比较偏物理和理论。事实上我现在正好在做一个完全是生物信息方面的工作,就是斯坦福医院的一个医生有一些临床数据,就找我来帮他处理数据,我在这个过程中更像是扮演了一个物理或计算机背景的人,也很希望有更多比我更懂物理和计算机的人能加入这个圈子。
《硅谷101》:如果他需要的是物理和计算机的信息,为什么他不找物理或计算机系的学生,而是找生物系的博士后来做这部分工作。
史寒朵:好问题,本质上现在跨学科合作沟通之间有个很深的沟。
《硅谷101》:是大家互相不了解,比如学计算机的并不了解生物领域原来需要这么多计算机知识。
史寒朵:这是一方面。另一方面是,如果我们真的找了一个只懂生物和一个只懂计算机的人,他们之间的沟通交流成本很高:学生物的会说我想处理这个数据,想得到生物上的什么结论;但学计算机的人只会问,这个算法需要什么输入,要算什么东西,希望得到什么输出。双方不是在同一频道上交流。

DeepMind首席执行官Demis Hassabis曾提到,希望AlphaFold为其他科学家所用,公司在了解生物学家对AlphaFold有何要求。来源:OLI SCARFF/AFP/Getty
很多人会在合作中比较沮丧,合作者会说,我的算法对这个数据的精度要求很高,有没有办法拿到更高精度或更多的数据,比如只有3只小鼠的数据,但如果要算法有比较好的表现需要100只小鼠的数据,可100只小鼠的数据可能是大家3年的工作量。有时领域之间的互不了解会导致对话无法进行下去,这样的交流成本太高,还不如自己做省时间。但如果有很多懂生物的计算机学家,可能这个问题会好很多。04 硅谷两年内出现上百家生物创业公司
《硅谷101》:最近生物学上的重大进展有一个是基因编辑技术,然后还有一个是mRNA疫苗技术。基因编辑从出现到拿诺贝尔奖也没多久,为什么短短几年内会出现这么多生物领域的突破和创新呢?有没有一些基础科学的研究突破?
史寒朵:基础科学的进步和新技术之间是迭代的过程,能起到相互促进的结果。
基因编辑技术,CRISPR不是第一个,很可能也不是最后一个,但CRISPR的出现把技术门槛降到了一个程度,基本上所有实验室都能做,在所有的生物里都可以做。之前的一些基因编辑技术,相对来说更复杂,做起来对实验室、在哪些动植物里面实现,限制也相对比较多,就很限制他们的发展。技术简化之后,门槛低了,有更多人能做了。
另一方面,很大程度上也有运气的成分。这两年南湾已经有上百家生物技术的创业公司,以前也有一些大的生物技术公司,比如GeneTech就在那边。
谷歌之前收购的Verily(谷歌致力于生命科学的研究部门),也在那一片,都是相对来说比较成规模的公司。现在又多了很多小型初创公司,一方面是形成了集群效应,听说大家的器械和各种资源也可以共享。科技上很多风投公司,现在也很看好一些新的生物技术,资金上的加成和人才的流入很大程度上也会加速行业的发展。
《硅谷101》:说明大家在看这个方向了,所以你会继续做学术,还是有意向加入生物创业公司?
史寒朵:我个人还是倾向做学术,我对发现的这类工作更感兴趣,更喜欢做科学一点点。
《硅谷101》:这么多技术出现以后,像CRISPR技术把基因编辑的门槛大大降低,AlphaFold把蛋白质结构公布,从研究到产业的转换链条是否正在变短?
史寒朵:是的,而且这个线现在也越来越不清晰了。斯坦福有很多教授在给生物技术公司做咨询,也有一部分在斯坦福做教授的同时,自己也开公司。他们经常是把科研成果直接转化到一些新兴的技术过程中,随着大家创业门槛降低之后,这类事情应该会越来越常见。
《硅谷101》:在你研究的方向,有什么细分领域可以很快从研究转向应用?
史寒朵:以我个人经验来看,肠道菌群是个很有意义同时也很有希望的长期方向。
一方面,我们可以通过测量肠道菌群来预测一个人的健康状况,再想远一点,甚至可以根据一个人现在的肠道菌群来设计一个膳食计划表。有一天可能会实现,测肠道菌群发现自己缺某一种菌,之后几天通过多喝酸奶来补充特定的益生菌,让身体回到最健康的状态。
《硅谷101》:我看到你在知乎上的一系列关于肠道菌群的专栏,觉得好有意思。比如你提出了一个好问题,如果真的吃一个体质瘦的人的屎,是不是能变瘦?
史寒朵:我也希望这样,但现在好像没有很强的动力尝试。因为目前我们对肠道菌群的了解还比较有限,如果只是为了减肥,那么风险就有点大,因为你不知道吃了别人的屎之后会有什么副作用。但这个过程,科学上来讲叫粪菌移植,就是把一个人的肠道菌群移植到另一个人体内,这个手段在治疗特定疾病,比如溃疡性结肠炎之类,确实已经是非常成熟的手段。
《硅谷101》:已经是应用了,对吗?
史寒朵:对。只是应用的范围还比较小,基本上是对于比较严重的病人,其他治疗手段都没有效果时,再考虑实行。
《硅谷101》:这个方向还是挺有应用前景的。
史寒朵:是的,当然更希望,研究清楚之后就不用那么复杂了,可以从头开始在实验室培养需要的细菌,然后移植这些固定的细菌,风险就会小很多。
《硅谷101》:这个领域研究清楚后,就可以直接产业化了。
史寒朵:是的。所以觉得这可能是未来5-10年内比较有希望产业落地的一个方向。
《硅谷101》:比如它可以解决便秘、乳糖不耐受甚至胖瘦的问题,还包括很多疾病。
史寒朵:是的。
相关推荐
AlphaFold攻破生物学50年难题,碳基创新加速度
生物史最全“证件照”:DeepMind开放35万种蛋白质结构,超人类知识2倍
进化版阿尔法狗来了,老年痴呆症攻克在即?
生物学的一个基本大问题迎来突破,它将改变一切
突破“生物学家50年未解难题”,这个AI终于可以免费用了
DeepMind祭出预测新冠病毒“蛋白质折叠”重磅武器:AlphaFold,精度碾压生物与病毒专家
真“碳基电路”:把细胞变成计算机?
算法攻破人脸识别「口罩」难题,两天落地千人小区准确率达97%
这是世纪级的机会:迎接深度技术浪潮的挑战
阿里达摩院发布2021十大科技趋势,人类有望借脑机接口超越生物学极限
网址: AlphaFold攻破生物学50年难题,碳基创新加速度 http://www.xishuta.com/newsview48528.html
推荐科技快讯

- 1问界商标转让释放信号:赛力斯 95185
- 2人类唯一的出路:变成人工智能 20919
- 3报告:抖音海外版下载量突破1 20809
- 4移动办公如何高效?谷歌研究了 20085
- 5人类唯一的出路: 变成人工智 20072
- 62023年起,银行存取款迎来 10313
- 7网传比亚迪一员工泄露华为机密 8460
- 8五一来了,大数据杀熟又想来, 8367
- 9滴滴出行被投诉价格操纵,网约 7989
- 10顶风作案?金山WPS被指套娃 7216