他们为什么能逃脱痴呆“家族诅咒”?
本文来自微信公众号:学术经纬 (ID:Global_Academia),药明康德内容团队编辑,原文标题:《逃脱了痴呆“家族诅咒”的超级幸运儿,打开攻克阿尔茨海默病的新大门》,题图来自:视觉中国(麦德林的传统花展)
在哥伦比亚的麦德林(Medellín)郊外,风景如画的山村里,生活着几个与世隔绝的大家族。很多年以来,那里的很多村民——称为派萨人(Paisas,源自西班牙语paisano,意为乡下人)——被一种“愚蠢病”的阴影笼罩:40多岁时开始说胡话,记忆衰退。村民们曾认为,这种病症是女巫的诅咒、教士的复仇或是摸了某棵不该摸的树而导致的。
实际上,真正的致病祸根是遗传性基因突变。30多年前,通过对派萨人家族的研究,科学家发现,位于第14号染色体上的一个基因发生突变会引起早发性阿尔茨海默病。该基因被命名为PSEN1,也就是早老性痴呆(presenile dementia)的缩写,其编码的蛋白称为早老素1(Presenilin 1)。
已被确诊为早发性阿尔茨海默病的6000多名家族成员身上,PSEN1基因仅仅发生了一个突变,即PSEN1-E280A。这一特定突变也因此被称为“派萨突变(Paisa mutation)”,是真正的“家族诅咒”:携带该突变的人大多在44岁前后出现轻度认知障碍,在49岁前后发展为痴呆症,并在60岁出头时死于痴呆症并发症。
幸运的是,有人逃脱了家族诅咒!
Francisco Lopera教授是最初发现这一家族的神经学家,30多年来,他始终在追踪调查其家族成员。他和同事们分析了来自该家族的1200名PSEN1突变携带者,都有早发性阿尔茨海默病的倾向。
他们在其中找到了一名特殊的男子:这名男子非常幸运,直到67岁时依然保持完好的认知功能,72岁时才出现轻度痴呆,相比其他家族成员,他把痴呆的命运推后了近30年!该男子最终因肺炎去世,享年74岁,死后家属向科研团队捐赠了他的大脑。
为什么这名幸运儿能抵挡“命中注定的”阿尔茨海默病?为了解开这一谜题,来自美国麻省总医院(MGH)、马萨诸塞州眼耳专科医院、德国汉堡-埃彭多夫大学医学中心(University Medical Center Hamburg-Eppendorf)等多家机构的科研人员组成了一支国际团队,在这个罕见病例的生前和死后通过神经影像学、遗传学和神经病理学等多个方面对其展开了详细分析。
日前,研究团队在权威学术期刊《自然-医学》上发表了他们的分析结果。
他们发现,这名男性之所以能够逃脱早发性阿尔茨海默病的“家族诅咒”,是因为他的RELN基因上出现了一个罕见的遗传变异,研究者称之为RELN-COLBOS(H3447R)。RELN基因编码的蛋白reelin已知在调节脑细胞发育和功能方面具有关键作用,而新发现的突变形式会使产生的蛋白功能增强。

无独有偶,在这个家族中,Lopera教授和同事们在2019年还找到过一名女性幸运儿,同样逃脱了PSEN1派萨突变的诅咒。这名女士同样直到70多岁才出现轻度认知障碍,也是把痴呆的命运推后了近30年,最后因癌症去世。
根据研究团队当时发表在《自然-医学》上的分析结果,该女士编码载脂蛋白E的基因APOE3上携带了罕见的保护性基因突变,称为“基督城(Christchurch)突变”。

▲有关该家族发现的第一名抵挡早发性阿尔茨海默病的幸运儿(图片来源:参考资料[3])
于是,在此次发表的论文中,研究团队接着对这两名延迟发病的特殊案例进行了比较,寻找他们的共同点。
研究者发现,两人的大脑中均出现了广泛且大量的淀粉样蛋白病理,这正是阿尔茨海默病的一个主要病理特点,但他们都没有因此而发展出严重的认知障碍。
另一方面,与阿尔茨海默病早期临床阶段有关的另一种病理性蛋白——tau蛋白缠结,在两人的脑中并不明显。尤其是对于此次的新病例来说,可以明显地观察到,其内嗅皮质积聚的tau蛋白十分有限。而内嗅皮层正是对于学习记忆非常关键的一个脑区。“新病例表明,内嗅皮层可能代表了一个虽小但对于防止痴呆至关重要的目标区域。”两篇论文的共同通讯作者之一、麻省总医院的Yakeel T. Quiroz博士指出。
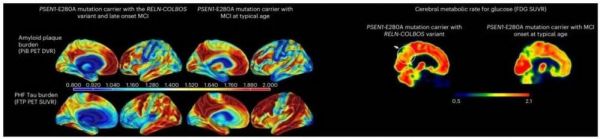
▲携带RELN-COLBOS(H3447R)的男子与其他携带派萨突变的典型家族成员的大脑对比(图片来源:参考资料[1])
尽管两个幸运儿的保护性基因突变出现在不同的基因上,分别影响了APOE变体和Reelin蛋白,但两者指向一个共同的疾病途径,这可能意味着耐受阿尔茨海默症的共同机制。
据研究者分析,Reelin蛋白相当于APOE的“表亲”,它们都会作为配体竞争性地结合类似的细胞受体,但作用相反。第一位幸运儿具备的APOE3罕见突变可能通过减少与受体的结合,最终抑制了患者大脑tau蛋白形成;第二位幸运儿具备的RELN罕见突变则通过功能增强,造成tau蛋白磷酸化下降,从而有效限制tau蛋白积聚。
“我们对这两个受保护的病例所做的研究其实就是去认识大自然母亲”,Lopera教授总结说:“最令人兴奋的是,大自然既向我们揭示了阿尔茨海默病的病因,也向我们揭示了治疗方法。大自然在这两个实验对象身上做了一个特殊的实验:既赋予了他们导致阿尔茨海默病的基因,同时又赋予了另一个基因,使他们在二三十年的时间里免受该病症状的影响。因此,解决方案就是师法自然,模仿这些基因变体的保护机制,开发出新疗法。”
参考资料
[1] Francisco Lopera et al., (2023) Resilience to autosomal dominant Alzheimer’s disease in a Reelin-COLBOS heterozygous man. Nature Medicine DOI: 10.1038/s41591-023-02318-3
[2] Mass General Brigham investigators identify new genetic variant protective against Alzheimer's disease. Retrieved May 15, 2023 from https://www.eurekalert.org/news-releases/989155
[3] Joseph F. Arboleda-Velasquez et al., (2019) Resistance to autosomal dominant Alzheimer’s disease in an APOE3 Christchurch homozygote: a case report Nature Medicine. DOI: 10.1038/s41591-019-0611-3
本文来自微信公众号:学术经纬 (ID:Global_Academia),药明康德内容团队编辑
相关推荐
知识的诅咒:为什么你知道的很多,表达得无力?
被资本忽视的线上密室逃脱
在中国,122万人正在“中年痴呆”
剧变时代的四大商业诅咒
36氪领读 | 混乱硅谷逃脱指南
硅谷CEO陷离职潮,创始人诅咒阴霾不散?
天才的诅咒
密室逃脱向左,剧本杀向右,狼人杀踟蹰不前
大佬们钟爱的家族信托,真的能保护财产吗?
当“拆分诅咒”降临科技界
网址: 他们为什么能逃脱痴呆“家族诅咒”? http://www.xishuta.com/newsview75041.html
推荐科技快讯

- 1问界商标转让释放信号:赛力斯 95121
- 2人类唯一的出路:变成人工智能 20508
- 3报告:抖音海外版下载量突破1 20339
- 4移动办公如何高效?谷歌研究了 19692
- 5人类唯一的出路: 变成人工智 19621
- 62023年起,银行存取款迎来 10269
- 7网传比亚迪一员工泄露华为机密 8397
- 8五一来了,大数据杀熟又想来, 8015
- 9滴滴出行被投诉价格操纵,网约 7639
- 10顶风作案?金山WPS被指套娃 7184